艾力达完整处方信息
(伐地那非HCI)片剂
描述
药理学
适应症和用法
禁忌症
警告
预防措施
药物的相互作用
不良反应
过量
剂量
提供
描述
LEVITRA®是一种治疗勃起功能障碍的口服疗法。这种伐地那非的单盐酸盐盐是环鸟苷单磷酸(cGMP)特异性磷酸二酯酶5型(PDE5)的选择性抑制剂。
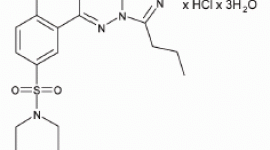
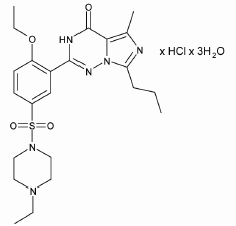
盐酸伐地那非化学名称为哌嗪,1-[[3-(1,4-二氢-5-甲基-4-氧-7-丙基咪唑[5,1-f][1,2,4]三嗪-2-基)-4-乙氧基]磺酰基]-4-盐酸单盐酸盐,其分子式如下:
盐酸伐地那非是一种几乎无色的固体物质,分子量为579.1 g/mol,在水中的溶解度为0.11 mg/mL。LEVITRA为橙色圆形薄膜包衣片剂,一面“BAYER”交叉凹印,另一面“2.5”、“5”、“10”和“20”分别对应2.5 mg、5 mg、10 mg和20 mg伐地那非。除了有效成分盐酸伐地那非外,每片还含有微晶纤维素、交孢维酮、胶体二氧化硅、硬脂酸镁、羟丙纤维素、聚乙二醇、二氧化钛、黄氧化铁和红氧化铁。
临床药理学
作用机制
阴茎勃起是由海绵体平滑肌及其相关小动脉松弛引起的血流动力学过程。性刺激时,神经末梢和海绵体内皮细胞释放一氧化氮。一氧化氮激活鸟苷酸环化酶,导致海绵体平滑肌细胞中环状单磷酸鸟苷(cGMP)的合成增加。cGMP反过来触发平滑肌松弛,允许更多的血液流入阴茎,导致勃起。cGMP的组织浓度由磷酸二酯酶(PDEs)的合成和降解速率共同调节。人类海绵体中最丰富的PDE是cgmp特异性磷酸二酯酶5型(PDE5);因此,抑制PDE5可以通过增加cGMP的含量来增强勃起功能。因为性刺激是启动一氧化氮的局部释放所必需的,在没有性刺激的情况下,抑制PDE5没有效果。体外研究表明伐地那非是PDE5的选择性抑制剂。伐地那非对PDE5的抑制作用比其他已知的磷酸二酯酶更具选择性(>是PDE6的15倍,>是PDE1的130倍,>是PDE11的300倍,>是PDE2、3、4、7、8、9和10的1000倍)。
药物动力学
伐地那非的药代动力学在推荐剂量范围内近似成剂量比例。伐地那非主要通过肝脏代谢消除,主要通过CYP3A4和少量CYP2C亚型消除。与强CYP3A4抑制剂(如利托那韦、茚地那韦、酮康唑、伊曲康唑)以及中度CYP3A抑制剂(如红霉素)同时使用可显著增加伐地那非的血浆水平(见预防措施,警告而且用量和给药).图1描述了给健康男性志愿者单次口服20mg伐地那非后测量的平均血浆浓度。
图1:单次20mg LEVITRA剂量的伐地那非血浆浓度(平均±SD)曲线

吸收:伐地那非吸收迅速,绝对生物利用度约为15%。健康志愿者在禁食状态下口服给药30分钟至2小时(中位数60分钟)后达到单次20mg剂量后观察到的最大血浆浓度。两项食物效应研究表明,高脂肪食物导致Cmax降低18%-50%。
分布:伐地那非的平均稳态分布容积(Vss)为208 L,表明广泛的组织分布。伐地那非及其主要循环代谢物M1与血浆蛋白高度结合(母体药物和M1约95%)。这种蛋白质结合是可逆的,与总药物浓度无关。
在健康志愿者中单次口服20mg伐地那非后,在给药1.5小时后的精液中平均获得给药剂量的0.00018%。
代谢:伐地那非主要由肝酶CYP3A4代谢,CYP3A5和CYP2C亚型也有作用。主要的循环代谢物M1,由伐地那非哌嗪部分的去乙基化产生。M1受到进一步的代谢。M1的血浆浓度约为母体化合物的26%。该代谢物表现出与伐地那非相似的磷酸二酯酶选择性特征,并且对PDE5的体外抑制效力是伐地那非的28%。因此,M1约占总药理活性的7%。
排泄:伐地那非的全身清除率为56 L/h,伐地那非及其主要代谢物(M1)的终末半衰期约为4-5小时。口服后,伐地那非主要作为代谢物排出在粪便中(约为口服剂量的91-95%),少量通过尿液排出(约为口服剂量的2-6%)。
特殊人群的药代动力学
儿科:伐地那非试验未在儿科人群中进行。
老年病学:在一项针对老年男性(>为65岁)和年轻男性(18 - 45岁)的健康志愿者研究中,老年男性的平均Cmax和AUC分别高出34%和52%预防措施,老年使用和用量和给药).因此,对于年龄为≥65岁的患者,应考虑较低的起始剂量(5 mg)。
肾功能不全在轻度肾损害(CLcr = 50-80 ml/min)的志愿者中,伐地那非的药代动力学与肾功能正常的对照组相似。中度(CLcr = 30- 50ml /min)或重度(CLcr = 80ml /min)。伐地那非在需要肾透析的患者中的药代动力学尚未得到评估预防措施、肾功能不全和用量和给药).
肝不足:在轻度肝功能损害的志愿者(Child- Pugh A)中,与健康对照组相比,10 mg伐地那非剂量后的Cmax和AUC分别增加了22%和17%。在中度肝损害(Child-Pugh B)志愿者中,与健康对照组相比,10 mg伐地那非剂量后的Cmax和AUC分别增加了130%和160%。因此,对于中度肝损害的患者,建议起始剂量为5mg,最大剂量不应超过10mg(见预防措施而且用量和给药).伐地那非尚未在严重(Child-Pugh C)肝功能损害患者中进行评估。
药效学
对血压的影响:在一项针对勃起功能障碍患者的临床药理学研究中,单剂量伐地那非20mg导致仰卧位收缩压平均最大降低7 mm Hg和舒张压平均最大降低8 mm Hg(与安慰剂相比),同时心率平均最大增加4次/分钟。血压的最大下降发生在给药后1 - 4小时。在多次给药31天后,第31天观察到与第1天相似的血压反应。伐地那非可增加降压药的降压效果(见禁忌症,预防措施,药物的相互作用).
LEVITRA与硝酸盐联合使用时对血压和心率的影响一项研究评估了18名健康受试者在舌下服用0.4 mg硝酸甘油(NTG)前不同时间用LEVITRA 20 mg预处理后的血压和心率反应。在服用NTG时,LEVITRA 20 mg引起了额外的时间相关的血压降低和心率增加。当LEVITRA 20 mg在NTG前1或4小时给药时,观察血压的影响;当20 mg在NTG前1、4或8小时给药时,观察心率的影响。当在NTG前24小时给药LEVITRA 20 mg时,未检测到额外的血压和心率变化。(参见图2。)
图2:在舌下给药0.4 mg NTG前24、8、4和1小时预给药LEVITRA 20mg对平均最大血压和心率影响的安慰剂减去点估计(90% CI)。
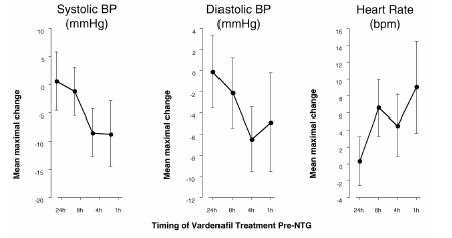
因为需要硝酸盐治疗的患者的疾病状态预计会增加低血压的可能性,在硝酸盐治疗或一氧化氮供体的患者使用伐地那非是禁忌的(见禁忌症).
电生理学59名45-60岁健康男性(81%白人,12%黑人,7%西班牙裔)在单剂量、双盲、随机、安慰剂和主动对照(莫西沙星400 mg)交叉研究中评价了10 mg和80 mg伐地那非对QT间期的影响。QT间期在给药后1小时测量,因为这个时间点接近伐地那非浓度峰值的平均时间。之所以选择80 mg LEVITRA剂量(最高推荐剂量的4倍),是因为该剂量产生的血浆浓度覆盖了低剂量LEVITRA (5 mg)和利托那韦600 mg BID联合给药时观察到的浓度。在已研究的CYP3A4抑制剂中,利托那韦与伐地那非的药物相互作用最为显著。表1总结了不同校正方法(Fridericia和线性个体校正方法)对给药后1小时平均未校正QT和平均校正QT间期(QTc)的影响。没有一种纠正方法比另一种更有效。在这项研究中,与安慰剂相比,10 mg LEVITRA剂量组的平均心率增加为5次/分钟,80 mg LEVITRA剂量组的平均心率增加为6次/分钟。
表1.剂量后1小时msec相对于安慰剂的平均QT和QTc变化(90% CI),采用不同的方法来校正心率的影响。
表1。平均QT和QTc剂量后1小时相对于安慰剂的msec变化(90% CI),采用不同的方法来校正心率的影响。 |
|||
药物和剂量 |
QT未校正(msec) |
Fridericia QT校正(msec) |
个体QT校正(msec) |
伐地那非10毫克 |
-2 (- 4,0) |
8 (6,9) |
4 (3,6) |
伐地那非80毫克 |
-2 (- 4,0) |
10(8、11) |
6 (4,7) |
莫西沙星* 400毫克 |
3 (1,5) |
8 (6,9) |
7 (5,8) |
主动对照(已知延长QT的药物) |
|||
治疗剂量和超治疗剂量的伐地那非和主动对照莫西沙星产生类似的QTc间隔增加。然而,这项研究并不是为了在药物或剂量水平之间进行直接的统计比较。这些QTc变化的实际临床影响尚不清楚。(见预防措施).
冠状动脉疾病(CAD)患者平板运动试验的影响:在两项独立试验中,分别评估了10 mg (n=41)和20 mg (n=39)伐地那非,与安慰剂相比,伐地那非没有改变平板运动总时间。患者人群包括年龄40-80岁的男性,稳定的运动性心绞痛,至少有以下一种记录:1)既往心肌梗死、冠脉搭桥、PTCA或支架置入史(6个月内除外);2)冠状动脉造影阳性,显示至少一条主要冠状动脉直径缩小至少60%;或3)正应激超声心动图或应激核灌注研究。
这些研究结果表明,与安慰剂相比,LEVITRA不会改变跑步机运动的总时间(10 mg LEVITRA与安慰剂:分别为433±109和426±105秒;20 mg LEVITRA vs安慰剂:分别为414±114和411±124秒)。与安慰剂相比,LEVITRA发生心绞痛的总时间没有改变(10 mg LEVITRA vs安慰剂:291±123和292±110秒;20 mg LEVITRA vs安慰剂:分别为354±137和347±143秒)。10mg LEVITRA组和20mg LEVITRA组到1mm或更大的STsegment凹陷的总时间与安慰剂组相似(10mg LEVITRA vs安慰剂:380±108和334±108秒;20 mg LEVITRA vs安慰剂:分别为364±101和366±105秒)。
视力影响单次口服磷酸二酯酶抑制剂经法恩斯沃斯-孟塞尔100色相试验证明,与剂量相关的颜色辨别(蓝/绿)的瞬时损伤和视网膜电图(ERG) b波振幅的降低,其峰值效应接近血浆水平峰值。这些发现与视网膜中参与光转导的视杆细胞和视锥细胞中PDE6的抑制一致。这些结果在给药1小时后最为明显,在给药6小时后逐渐减弱,但仍存在。在25名正常男性的单次剂量研究中,LEVITRA 40mg(每日最大推荐剂量的两倍)没有改变视力、眼压、眼底镜和裂隙灯的结果。
临床研究
艾力达在四项主要双盲、随机、安慰剂对照、固定剂量、平行设计、多中心试验中进行评估,共纳入2431名20-83岁男性(平均年龄57岁;78%的白人,7%的黑人,2%的亚洲人,3%的西班牙人和10%的其他/未知)。这些研究中LEVITRA的剂量分别为5 mg、10 mg和20 mg。其中两项试验在普通ED人群中进行,两项试验在特殊ED人群中进行(一项在糖尿病患者中进行,一项在前列腺切除术后患者中进行)。LEVITRA在患有勃起功能障碍(ED)的男性患者中按需给药,不考虑饮食,其中许多人患有多种其他疾病。雷竞技到底好不好用主要终点在3个月时进行评估。
所有四个主要试验的主要疗效评估是通过有效的国际勃起功能指数(IIEF)问卷的勃起功能(EF)域评分,以及性接触概况(SEP)中的两个问题,涉及实现阴道插入的能力(SEP2)和维持勃起足够长时间以成功性交的能力(SEP3)。
在所有四项固定剂量疗效试验中,与安慰剂相比,LEVITRA在EF Domain、SEP2和SEP3评分上显示出具有临床意义和统计学意义的改善。这些试验的EF Domain平均基线得分为11.8(得分范围为0-30,其中得分越低代表疾病越严重)。LEVITRA (5mg、10mg和20mg)对所有年龄类别(<45岁、45 - 65岁)均有效,且对任何种族(白人、黑人、其他)均有效。
在一般勃起功能障碍人群中的试验在主要的北美固定剂量试验中,评估了762例患者(平均年龄57岁,20-83岁,79%白人,13%黑人,4%西班牙裔,2%亚洲人和2%其他)。LEVITRA 5 mg、10 mg、20 mg组和安慰剂组EF Domain平均基线评分分别为13、13、13、14。与安慰剂组(EF Domain评分为15)相比,LEVITRA治疗3个月后有显著改善(p<0.0001) (5 mg、10 mg和20 mg剂量组EF Domain评分分别为18、21、21)。欧洲试验(总N=803)证实了这些结果。在北美试验中,6个月时所有剂量均维持了平均得分的改善。
在北美试验中,与安慰剂相比,5 mg、10 mg和20 mg剂量LEVITRA显著提高了实现足够插入勃起(SEP2)的比率(分别为65%、75%和80%,而安慰剂在3个月时的反应为52%;p < 0.0001)。欧洲的试验证实了这些结果。
在北美试验中,LEVITRA在3个月的临床试验中显示出了具有临床意义和统计学意义的整体患者勃起维持率(SEP3)的增加(5mg组为51%,10mg组为64%,20mg组为65%,而安慰剂组为32%,p< 0.0001)。欧洲的试验显示了类似的疗效。在北美试验中,6个月时所有剂量均维持了这种平均得分的改善。
在ED和糖尿病患者中的试验:在一项前瞻性、固定剂量(10和20 mg LEVITRA)、双盲、安慰剂对照试验中,LEVITRA在糖尿病患者勃起功能方面表现出具有临床意义和统计学意义的改善(n=439;平均年龄57岁,33-81岁;80%的白人,9%的黑人,8%的西班牙裔和3%的其他)。
本研究显示EF域有显著改善(与安慰剂组13相比,10 mg LEVITRA组EF域得分为17,20 mg LEVITRA组为19;p < 0.0001)。
LEVITRA显著提高了每个患者实现足够插入勃起的整体率(SEP2) (10mg LEVITRA组61%,20mg LEVITRA组64%,安慰剂组36%;p < 0.0001)。
LEVITRA在每个患者的勃起维持率到成功性交(SEP3)方面有临床意义和统计学上的显著增加(10mg组为49%,20mg组为54%,安慰剂组为23%;p < 0.0001)。
根治性前列腺切除术后ED患者的试验:一项前瞻性、固定剂量(10和20 mg LEVITRA)、双盲、安慰剂对照试验显示,LEVITRA在前列腺切除术后患者(n=427,平均年龄60岁,44-77岁;93%白人,5%黑人,2%其他)。
本研究显示EF域有显著改善(与安慰剂组9分相比,10 mg LEVITRA组EF域评分为15分,20 mg LEVITRA组为15分;p < 0.0001)。
LEVITRA显著提高了每个患者实现足够插入勃起的整体率(SEP2) (10mg LEVITRA组为47%,20mg LEVITRA组为48%,安慰剂组为22%;p < 0.0001)。
LEVITRA在维持勃起到成功性交(SEP3)的每个患者的整体发生率(10mg组为37%,20mg组为34%,安慰剂组为10%)方面显示出具有临床意义和统计学意义的显著增加;p < 0.0001)。
适应症和用法
LEVITRA适用于勃起功能障碍的治疗。
禁忌症
硝酸盐: LEVITRA与硝酸盐(定期和/或间歇性)和一氧化氮供体合用是禁忌症(见临床药理学,药效学,LEVITRA与硝酸盐合用时对血压和心率的影响)。与PDE5抑制一氧化氮/环鸟苷单磷酸通路的作用一致,PDE5抑制剂可能增强硝酸盐的低血压作用。对于硝酸盐或一氧化氮供体的安全管理,LEVITRA给药后的合适时间间隔尚未确定。
α-受体阻滞剂:由于α -受体阻滞剂和艾力达联合使用可产生低血压,因此艾力达在服用α -受体阻滞剂的患者中是禁忌症预防措施,药物的相互作用).
超敏反应: LEVITRA是已知对该片任何成分过敏的患者的禁忌症。
警告
心血管的影响
一般医生应考虑病人的心血管状况,因为性活动有一定程度的心脏病风险。对于因潜在心血管状况而不建议进行性活动的男性,一般不应使用任何治疗勃起功能障碍的药物,包括艾力达。
左室流出道梗阻:左室流出道梗阻患者,如主动脉瓣狭窄和特发性肥厚性主动脉下狭窄,可能对包括5型磷酸二酯酶抑制剂在内的血管扩张剂的作用敏感。
血压的影响: LEVITRA具有全身性血管舒张特性,可导致健康志愿者仰卧位血压短暂下降(平均最大收缩压下降7 mmHg,舒张压下降8 mmHg)(见临床药理学,药理学)。虽然这通常预计对大多数患者的影响很小,但在开LEVITRA处方之前,医生应该仔细考虑他们的患有潜在心血管疾病的患者是否会受到这种血管舒张作用的不利影响。
联合应用强效CYP3A4抑制剂的效果
瓦地那非与HIV蛋白酶抑制剂合用的长期安全性信息尚不清楚。与利托那韦或因地那韦同时使用可显著增加伐地那非的血药浓度。利托那韦或茚地那韦是CYP3A4代谢的强抑制剂,为减少患者同时服用利托那韦或茚地那韦时发生不良事件的机会,不应超过LEVITRA最大单次剂量2.5 mg。由于利托那韦延长了LEVITRA消除半衰期(5-6倍),同时服用利托那韦的患者在72小时内不应服用超过2.5 mg剂量的LEVITRA。服用茚地那韦、酮康唑400 mg /天或伊曲康唑400 mg /天的患者不应超过LEVITRA 2.5 mg /天,1次。对于每天服用酮康唑或伊曲康唑200 mg的患者,24小时内不应超过单剂量5 mg LEVITRA(见预防措施,药物的相互作用而且用量和给药).
其他影响
这类化合物(包括伐地那非)有超过4小时的长时间勃起和勃起勃起(持续时间超过6小时的疼痛勃起)的罕见报道。如果勃起持续超过4小时,患者应立即寻求医疗援助。如果阴茎勃起不立即治疗,阴茎组织损伤和永久丧失效力可能会导致。
临床试验中未研究的患者亚组
LEVITRA在以下患者中的安全性或有效性尚无对照临床数据;因此,在获得进一步信息之前,不建议使用它。
-不稳定性心绞痛;低血压(静息收缩压170/110毫米汞柱);最近有中风、危及生命的心律失常或心肌梗死病史(最近6个月内);严重心衰-严重肝功能损害(Child-Pugh C) -需要透析的终末期肾病-已知的遗传性退行性视网膜疾病,包括色素性视网膜炎
预防措施
勃起功能障碍的评估应包括确定潜在的潜在原因、医学评估和确定适当的治疗方法。
在开艾力达处方前,务必注意以下事项:
α-受体阻滞剂:当PDE5抑制剂与α -受体阻滞剂合用时,建议谨慎。磷酸二酯酶5型(PDE5)抑制剂,包括LEVITRA和α -肾上腺素能阻滞剂都是具有降低血压作用的血管扩张剂。当血管扩张剂联合使用时,可能会对血压产生附加效应。在一些患者中,同时使用这两类药物可显著降低血压(见注意事项,药物相互作用),导致症状性低血压(例如,昏厥)。应考虑以下事项:
- 在开始使用PDE5抑制剂之前,患者应该在α -受体阻滞剂治疗中保持稳定。仅使用α -受体阻滞剂治疗出现血流动力学不稳定的患者在同时使用PDE5抑制剂时出现症状性低血压的风险增加。
- 对于那些α -受体阻滞剂治疗稳定的患者,PDE5抑制剂应以最低推荐起始剂量开始使用(见剂量和给药)。
- 对于已经服用最佳剂量PDE5抑制剂的患者,α -受体阻滞剂治疗应以最低剂量开始。α -受体阻滞剂剂量的逐步增加可能与服用PDE5抑制剂的患者血压进一步降低有关。
- PDE5抑制剂和α -受体阻滞剂联合使用的安全性可能受到其他变量的影响,包括血管内容量消耗和其他抗高血压药物。
肝功能不全:在中度损伤志愿者(Child-Pugh B)中,与健康对照组相比,10 mg伐地那非剂量后的Cmax和AUC分别增加了130%和160%。因此,对于中度肝损害的患者,建议起始剂量为5mg,最大剂量不应超过10mg(见临床药理学,特殊人群的药代动力学和用量和给药).伐地那非尚未在严重肝功能损害患者中进行评估(Child-Pugh C)。
先天性或获得性QT间期延长:在一项关于LEVITRA对59名健康男性QT间期影响的研究中(见临床药理学,电生理学),治疗剂量(10mg)和超治疗剂量(80mg) LEVITRA和主动对照莫西沙星(400mg)产生类似的QTc间期增加。在开LEVITRA处方时,临床决策应考虑这一观察结果。患有先天性QT延长的患者和正在服用IA类(如奎尼丁、普鲁卡因酰胺)或III类(如胺碘酮、索他洛尔)抗心律失常药物的患者应避免使用LEVITRA。
肾功能不全:中度(CLcr = 30- 50ml /min)至重度(CLcr为80ml /min)患者(见临床药理学,特殊人群的药代动力学)。伐地那非在肾透析患者中的药代动力学尚未得到评估。
一般:在人类中,伐地那非单独剂量不超过20mg不会延长出血时间。没有临床证据表明伐地那非与阿司匹林合用会增加出血时间。伐地那非尚未用于出血障碍或明显活动性消化性溃疡患者。因此,这些患者应在仔细的获益-风险评估后使用LEVITRA。
阴茎解剖变形(如成角、海绵体纤维化或佩罗尼氏病)的患者或有勃起倾向的患者(如镰状细胞性贫血、多发性骨髓瘤或白血病)通常应谨慎使用勃起功能障碍的治疗。雷竞技到底好不好用
LEVITRA联合其他治疗方法治疗勃起功能障碍的安全性和有效性尚未得到研究。因此,不建议使用这种组合。
患者须知
医生应与患者讨论LEVITRA的禁忌症与定期和/或间歇使用有机硝酸盐。应告知患者,LEVITRA与硝酸盐同时使用可能导致血压突然下降到不安全水平,导致头晕、晕厥,甚至心脏病发作或中风。
医生应告知患者,艾力达与受体阻滞剂合用是禁忌的,因为合用会产生低血压(例如昏厥)。服用α -受体阻滞剂的LEVITRA患者应按最低推荐起始剂量开始服用LEVITRA(见药物相互作用和剂量与给药)。患者应被告知可能发生的体位性低血压相关症状和适当的对策。如果其他医疗机构开了其他可能与艾力达相互作用的抗高血压药物或新药,应建议患者联系开处方的医生。
医生应建议患者停止使用所有PDE5抑制剂,包括艾力达,并在发生单眼或双眼视力突然丧失时就医。这种事件可能是非动脉性前缺血性视神经病变(NAION)的征兆,NAION是视力下降的原因,包括永久性视力丧失,在上市后与使用所有PDE5抑制剂的时间关联中很少有报道。不可能确定这些事件是否与PDE5抑制剂的使用直接相关或与其他因素有关。医生还应与患者讨论单眼已发生NAION的个体发生NAION的风险增加,包括使用PDE5抑制剂等血管扩张剂是否会对此类个体产生不利影响(见上市后经验/眼科)。
医生应与患者讨论既往存在心血管危险因素的患者的性活动的潜在心脏风险。
使用艾力达不能预防性传播疾病。应考虑向患者提供有关预防性传播疾病,包括人体免疫缺陷病毒(艾滋病毒)的必要保护措施的咨询。
医生应告知患者,有罕见的报告显示,LEVITRA和这类化合物的勃起时间超过4小时,勃起勃起疼痛(持续时间超过6小时)。如果勃起持续超过4小时,患者应立即寻求医疗援助。如果阴茎勃起不立即治疗,阴茎组织损伤和永久丧失效力可能会导致。
药物的相互作用
其他药物对LEVITRA的影响
体外研究:对人肝微粒体的研究表明,伐地那非主要由细胞色素P450 (CYP)异构体3A4/5代谢,少量由CYP 2C9代谢。因此,这些酶的抑制剂有望降低伐地那非的清除率(见警告而且用量和给药).
体内研究:细胞色素P450抑制剂
在健康志愿者中,西咪替丁(400 mg b.i.d)与20 mg LEVITRA联合给药时,对伐地那非的生物利用度(AUC)和最大浓度(Cmax)没有影响。红霉素(500mg t.i.d)与艾力达5mg联合给药时,健康志愿者伐地那非AUC增加4倍,Cmax增加3倍用量和给药).当与红霉素联合使用时,建议在24小时内不要超过单次5 mg剂量的LEVITRA。
在健康志愿者中,酮康唑(200mg,每日一次)与LEVITRA (5mg)联合使用时,伐地那非AUC增加10倍,Cmax增加4倍。当与每日一次酮康唑200mg联合使用时,不应超过5mg LEVITRA剂量。由于较高剂量的酮康唑(每日400毫克)可能导致Cmax和AUC的更高增加,当与每日400毫克酮康唑联合使用时,单剂量2.5 mg LEVITRA不应在24小时内超过(见警告而且用量和给药).
HIV蛋白酶抑制剂:
茚地那韦(800 mg t.i.d)与艾力达10 mg联合用药可使伐地那非AUC增加16倍,伐地那非Cmax增加7倍,伐地那非半衰期增加2倍。当与茚地那韦联合使用时,建议在24小时内不要超过单个2.5 mg LEVITRA剂量警告而且用量和给药).
利托那韦(600mg b.i.d)与艾力达5 mg联合用药导致伐地那非AUC增加49倍,伐地那非Cmax增加13倍。这种相互作用是利托那韦阻断伐地那非肝脏代谢的结果,利托那韦是一种高效的CYP3A4抑制剂,也抑制CYP2C9。利托那韦显著延长了伐地那非的半衰期至26小时。因此,当与利托那韦联合使用时,建议在72小时内不要超过单个2.5 mg LEVITRA剂量警告而且用量和给药).
其他药物相互作用:未观察到伐地那非与以下药物的药代动力学相互作用:格列本脲、华法林、地高辛、Maalox和雷尼替丁。在华法林的研究中,伐地那非对凝血酶原时间或其他药效学参数没有影响。
艾力达对其他药物的影响
体外研究:
伐地那非及其代谢产物对CYP1A2、2A6和2E1无影响(Ki > 100μM)。发现对其他亚型(CYP2C8, 2C9, 2C19, 2D6, 3A4)有微弱的抑制作用,但Ki值高于给药后的血浆浓度。观察到伐地那非代谢物M1对CYP3A4最有效的抑制活性,其Ki为1.4 μM,这是80 mg艾力达剂量后M1 Cmax值的约20倍。
体内研究:
硝酸盐:在健康的中年受试者中,瓦地那非后1和4小时服用舌下硝酸盐(0.4 mg)降低血压的作用,以及在1、4和8小时服用LEVITRA 20 mg剂量时增加心率的作用增强。当在NTG前24小时服用LEVITRA 20 mg时,没有观察到这些影响。硝酸盐对缺血性心脏病患者降压作用的增强作用尚未得到评估,同时使用LEVITRA和硝酸盐是禁忌的(见临床药理学艾力达与硝酸盐联用时对血压和心率的影响;禁忌症).
硝苯地平:伐地那非20毫克,与缓释硝苯地平30毫克或60毫克,每日一次,不影响硝苯地平的相对生物利用度(AUC)或最大浓度(Cmax),硝苯地平是一种通过CYP3A4代谢的药物。硝苯地平与LEVITRA合用时不会改变血浆水平。在这些使用硝苯地平控制高血压的患者中,LEVITRA 20 mg与安慰剂相比,平均可额外降低6/5 mm Hg的仰卧收缩压/舒张压。
α-受体阻滞剂:
稳定的α受体阻滞剂治疗对患者血压的影响:两项临床药理学研究对良性前列腺增生(BPH)患者进行了至少四周的稳定剂量α受体阻滞剂治疗。
研究1本研究的目的是评价5mg伐地那非对BPH患者慢性α -受体阻滞剂治疗的效果,分为两个单独的队列:坦索罗辛0.4 mg / d(队列1,n=21)和特拉唑嗪5或10mg / d(队列2,n=21)。该设计是一项随机、双盲、交叉研究,包括四种治疗方法:伐地那非5mg或安慰剂与α受体阻滞剂同时使用,伐地那非5mg或安慰剂在α受体阻滞剂使用6小时后使用。在伐地那非给药后6小时内评估血压和脉搏。BP结果见表2。1例患者同时使用5mg伐地那非和10mg特拉唑嗪治疗1小时后出现症状性低血压,站立血压80/ 60mmhg,随后出现轻度头晕和中度头晕,持续6小时。伐地那非组和安慰剂组,同时服用特拉唑嗪后,分别有5例和2例患者的站立收缩压(SBP)下降至>30 mmHg。当伐地那非5 mg和特拉唑嗪间隔6小时给药时,未观察到低血压。同时服用伐地那非5mg和坦索罗辛后,2例患者的站立收缩压为30mmhg。当坦索罗辛和伐地那非5 mg分离6小时时,2例患者的站立收缩压为30 mmHg。在研究过程中没有报道与低血压相关的严重不良事件。 There were no cases of syncope.
表2:BPH患者使用稳定的α受体阻滞剂治疗伐地那非5mg后收缩压(mmH)较基线的平均(95% C.I.)最大变化(研究1)
| 治疗组 | 同时给药伐地那非5mg和α -阻滞剂,安慰剂减去 | 伐地那非5mg与α -受体阻滞剂间隔6小时,安慰剂减去 | |
| 特拉唑嗪每日5或10毫克 | SBP站 | -3 (-6.7, 0.1) | -4 (-7.4, -0.5) |
| 仰卧的SBP | -4 (-6.7, -0.5) | -4 (-7.1, -0.7) | |
| 坦索罗辛每天0.4毫克 | SBP站 | -6 (-9.9, -2.1) | -4 (-8.3, -0.5) |
| 仰卧的SBP | -4 (-7.0, -0.8) | -5 (-7.9, -1.7) |
研究2:该研究的目的是评估10mg伐地那非(1期)和20mg伐地那非(2期)与安慰剂相比的效果,当对一个BPH患者队列(n=23)使用坦索罗辛0.4 mg或0.8 mg每日稳定治疗至少4周。设计为随机、双盲、两期交叉研究。伐地那非或安慰剂与坦索罗辛同时给予。在伐地那非给药后6小时内评估血压和脉搏。BP结果见表3。1例患者在伐地那非10 mg后,站立收缩压>较基线下降30 mmHg。没有其他异常血压值(站立收缩压30 mmHg)的例子。3例患者在服用伐地那非20mg后出现头晕。无晕厥病例。
表3:BPH患者使用稳定的α受体阻滞剂坦索罗辛0.4或0.8 mg每日治疗伐地那非10和20 mg后收缩压(mmHg)的平均(95% C.I.)最大变化(研究2)
| 伐地那非10毫克安慰剂减法 | 伐地那非20mg安慰剂减法 | |
| SBP站 | -4 (-6.8, -0.3) | -4 (-6.8, -1.4) |
| 仰卧的SBP | -5 (-8.2, -0.8) | -4 (-6.3, -1.8) |
只有当患者的α受体阻滞剂治疗稳定时,才应开始与伐地那非和α受体阻滞剂同时治疗。对于那些α -受体阻滞剂治疗稳定的患者,LEVITRA应以最低推荐起始剂量开始(见剂量和给药)。
-受体阻滞剂强制滴定对血压正常男性血压的影响:
两项随机、双盲、安慰剂对照的临床药理学研究对血压正常的健康志愿者(年龄范围,45-74岁)进行,在强制滴注alphablocker terazosin至每天10mg超过14天(n=29),并在开始坦索罗辛每天0.4 mg持续5天(n=24)后进行。两项研究均未发现与低血压相关的严重不良事件。低血压症状是2名接受特拉唑嗪的受试者和4名接受坦索罗辛的受试者停药的原因。9/24接受坦索罗辛的受试者和19/29接受特拉唑嗪的受试者观察到异常血压值(定义为站立收缩压30 mmHg)。长期收缩压<85 mmHg的受试者给予伐地那非和特拉唑嗪以达到同时Tmax,导致该研究过早终止。在大多数(7/8)受试者中,站立收缩压<85 mmHg与症状无关。在接受特拉唑嗪治疗的受试者中,伐地那非和特拉唑嗪同时给予Tmax比分别给予Tmax 6小时时观察到的异常值更频繁。同时服用特拉唑嗪和伐地那非时出现头晕3例。7名受试者出现头晕,主要发生在同时Tmax给药坦索罗新时。无晕厥病例。
表4。健康志愿者每日接受阿尔法阻滞剂治疗,伐地那非10和20mg后收缩压(mmHg)基线平均(95% C.I.)最大变化
| 伐地那非和α -阻滞剂间隔6小时给药 | 伐地那非和α -阻滞剂同时给药 | ||||
| 字母块 | 伐地那非10mg安慰剂-减去 | 伐地那非20mg安慰剂-减去 | 伐地那非10mg安慰剂-减去 | 伐地那非20mg安慰剂-减去 | |
| 特拉唑嗪每日10毫克 | SBP站 | -7 (-10, -3) | -11 (-14, -7) | -23 (- 31,16)* | -14 (- 33,11)* |
| 仰卧的SBP | -5 (-8, -2) | -7 (-11, -4) | -7 (- 25,19)* | -7 (- 31,22)* | |
| 坦索洛西0.4毫克每日 | SBP站 | -4 (-8, -1) | -8 (-11, -4) | -8 (-14, -2) | -8 (-14, -1) |
| 仰卧的SBP | -4 (- 8,0) | -7 (-11, -3) | -5 (-9, -2) | -3 (- 7,0) | |
*由于样本量的原因,置信区间可能不是这些数据的准确度量。这些值表示差值的范围。
图6:健康志愿者在同时或6小时分别给予伐地那非10mg、伐地那非20mg或安慰剂加特拉唑嗪(10mg)后6小时间隔内站立收缩压(mmHg)的平均变化
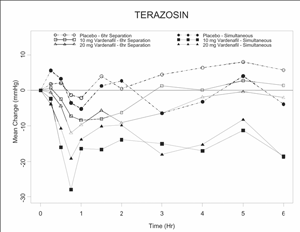
图7:健康志愿者在同时或6小时分离使用伐地那非10mg、伐地那非20mg或安慰剂加坦索罗辛(0.4 mg)后6小时间隔内站立收缩压(mmHg)的平均变化

利托那韦和因地那韦:同时给药5 mg LEVITRA和600 mg BID利托那韦,利托那韦的Cmax和AUC降低了约20%。在给予10 mg LEVITRA和800 mg TID茚地那韦时,茚地那韦的Cmax和AUC分别降低了40%和30%。
酒精:酒精(0.5 g/kg体重:一个70 kg的人大约40 mL无水酒精)和伐地那非血浆水平在同时给药时没有改变。在4小时观察期内,健康志愿者服用酒精(0.5 g/kg体重)时,LEVITRA (20mg)不会增强酒精的低血压作用。
阿司匹林:艾力达(10mg和20mg)不会增加阿司匹林(两片81 mg)引起的出血时间。
其他相互作用:LEVITRA对格列本脲(葡萄糖和胰岛素浓度)和华法林(凝血酶原时间或其他药效学参数)的药效学没有影响。
致癌,突变,生育力损害
在24个月的时间里,每天服用伐地那非对大鼠和小鼠没有致癌作用。在这些研究中,未结合(游离)伐地那非及其主要代谢物的全身药物暴露(auc)在雄性和雌性大鼠中分别约为400倍和170倍,在雄性和雌性小鼠中分别为21倍和37倍,给予人类最大推荐剂量(MRHD)为20毫克。在体外细菌艾姆斯试验或中国仓鼠V79细胞正向突变试验中,瓦尔地那非均无致突变性。在体外染色体畸变试验和小鼠体内微核试验中,伐地那非都没有致裂作用。伐地那非在雄性大鼠交配前28天、雌性大鼠交配前14天及妊娠第7天给予最高剂量100 mg/kg/天的伐地那非对雄性和雌性大鼠的生育能力均无损害。在相应的1个月大鼠毒性研究中,在MRHD为20 mg时,该剂量对未结合的伐地那非的AUC值比人的AUC值大200倍。
在健康志愿者中,单次口服20毫克伐地那非对精子活力或形态没有影响。
孕妇,哺乳期母亲和儿科使用
LEVITRA不适用于妇女、新生儿或儿童。伐地那非被分泌到哺乳期大鼠的乳汁中,其浓度大约是血浆中的10倍。单次口服剂量为3mg /kg后,给药剂量的3.3%在24小时内排泄到乳汁中。目前尚不清楚伐地那非是否会从人的母乳中排泄出来。
妊娠B类:在器官发生过程中,在大鼠和兔子中,未观察到特定的致畸性、胚胎毒性或胎儿毒性的证据。在MRHD为20 mg的情况下,该剂量比未结合的伐地那非及其主要代谢物在人体内的AUC值大约100倍(大鼠)和29倍(兔)。在大鼠产前和产后发育研究中,母毒性的NOAEL(未观察到不良反应水平)为8 mg/kg/天。在母体暴露于1和8 mg/kg后,在没有母体影响的情况下,观察到幼鼠的身体发育迟缓,这可能是由于血管扩张和/或药物分泌到乳汁中。出生前和出生后暴露于60毫克/公斤/天的大鼠出生的活仔数减少。根据产前和产后的研究结果,发育性NOAEL小于1毫克/公斤/天。根据大鼠发育毒性研究中的血浆暴露,在怀孕大鼠中,估计1mg/kg/天可产生未结合的伐地那非及其主要代谢物的总AUC值,与MRHD为20 mg时的人类AUC相当。目前尚无充分的、对照良好的瓦尔地那非孕妇试验。
老年使用
65岁及以上的老年男性比年轻男性(18 - 45岁)有更高的伐地那非血药浓度,平均Cmax和AUC分别高出34%和52%(见临床药理学、特殊人群的药代动力学和剂量和给药)。3期临床试验包括超过834名老年患者,当这些老年患者与年轻患者比较时,LEVITRA 5、10或20 mg的安全性或有效性没有差异。然而,由于老年伐地那非浓度增加,对于年龄为≥65岁的患者,应考虑5 mg LEVITRA的起始剂量。
不良反应
超过4430名男性(平均年龄56岁,范围18-89岁;81%白人,6%黑人,2%亚洲人,2%西班牙人和9%其他)。超过2200名患者接受6个月或更长时间的治疗,880名患者接受了至少1年的治疗。
在安慰剂对照临床试验中,LEVITRA因不良事件导致的停药率为3.4%,而安慰剂为1.1%。
当LEVITRA在安慰剂对照临床试验中按照建议服用时,报告了以下不良事件(见表2)。
表5:不良事件报告一个‰¥在5mg、10mg或20mg伐地那非固定和灵活剂量随机对照试验中,2%的患者接受LEVITRA治疗,药物治疗频率高于安慰剂
不良事件 |
患者报告事件的百分比 |
|
安慰剂N = 1199 |
艾力达n = 2203 |
|
头疼 |
4% |
15% |
冲洗 |
1% |
11% |
鼻炎 |
3% |
9% |
消化不良 |
1% |
4% |
意外伤害* |
2% |
3% |
鼻窦炎 |
1% |
3% |
流感综合征 |
2% |
3% |
头晕 |
1% |
2% |
肌酸激酶增加 |
1% |
2% |
恶心想吐 |
1% |
2% |
*除意外伤害外,上表所列事件均被视为药物不良反应。 |
||
g灵活剂量研究开始时,所有患者服用LEVITRA 10mg,并根据副作用和疗效将剂量减少至5mg或增加至20mg。 |
||
LEVITRA治疗组有2.0%的患者报告背部疼痛,安慰剂组有1.7%。
安慰剂对照试验表明,在一些不良事件(头痛、潮红、消化不良、恶心、鼻炎)发生率的剂量效应超过5 mg、10 mg和20 mg剂量的LEVITRA。以下部分列出了LEVITRA临床开发过程中报告的其他较不频繁的事件(<2%)。从这个列表中排除的是那些不常见和轻微的事件,那些在没有药物治疗的情况下可能经常观察到的事件,以及那些与药物没有合理关联的事件。
全身:过敏反应(包括喉水肿)、乏力、面部水肿、疼痛
身体整体:过敏反应(包括喉水肿)、乏力、面部水肿、疼痛听觉:耳鸣心血管:心绞痛、胸痛、高血压、低血压、心肌缺血、心肌梗死、心慌、体位性低血压、晕厥、心动过速消化:腹痛、肝功能检查异常、腹泻、口干、吞咽困难、食管炎、胃炎、胃食管反流、GGTP增高、呕吐肌肉骨骼:关节痛,背痛,肌痛,颈痛神经:高张力,感觉不良,失眠,感觉异常,嗜睡,眩晕呼吸:呼吸困难,鼻衄,咽炎皮肤及附件:光敏反应,瘙痒,皮疹,出汗眼科:视力异常,视力模糊,色觉,色觉改变,结膜炎(眼睛红肿加重),视力模糊,眼痛,青光眼,畏光,水眼泌尿生殖:异常射精,勃起(包括勃起时间延长或疼痛)
上市后经验
眼科
非动脉性前缺血性视神经病变(NAION)是导致视力下降包括永久性视力丧失的原因之一,在上市后很少报道与使用磷酸二酯酶5型(PDE5)抑制剂(包括LEVITRA)的时间相关性。这些患者中大多数(但不是全部)具有发生NAION的潜在解剖或血管危险因素,包括但不一定限于:低杯盘比(“拥挤的椎间盘”)、年龄超过50岁、糖尿病、高血压、冠状动脉疾病、高血脂和吸烟。尚不能确定这些事件是否与PDE5抑制剂的使用直接相关,与患者潜在的血管危险因素或解剖缺陷直接相关,与这些因素的组合相关,或与其他因素相关(见预防措施/患者信息)。
视力障碍包括视力丧失(暂时性或永久性),如视野缺损、视网膜静脉阻塞和视力下降,在上市后经验中也很少报道。不可能确定这些事件是否与使用LEVITRA直接相关。
过剂量
人体数据可获得的LEVITRA最大剂量是给8名健康男性志愿者单次120毫克。这些受试者中的大多数经历了可逆性背痛/肌痛和/或“视力异常”。
在过量的情况下,应按照要求采取标准的支持措施。肾透析不能加速清除,因为伐地那非与血浆蛋白高度结合,在尿液中不能明显消除。
用量和给药
对于大多数患者,LEVITRA的推荐起始剂量为10mg,在性活动前约60分钟口服。剂量可根据疗效和副作用增加至最大推荐剂量20mg或减少至5mg。最大推荐剂量为每天一次。艾力达可随食物服用或不随食物服用。性刺激是治疗反应所必需的。
老年病学:对于年龄为â‰- 65岁的患者,应考虑起始剂量为5mg艾力达(见临床药理学,特殊人群的药代动力学和预防措施).
肝损伤:对于轻度肝功能损害(Child- Pugh A)患者,不需要调整LEVITRA的剂量。中度肝功能损害患者伐地那非清除率降低(Child-Pugh B),建议起始剂量为5mg LEVITRA。中度肝功能损害患者的最大剂量不应超过10毫克。LEVITRA尚未在严重肝功能损害患者中进行评估(Child-Pugh C)临床药理学代谢与排泄警告而且预防措施).
肾功能损害:对于轻度(CLcr = 50-80 ml/min)、中度(CLcr = 30-50 ml/min)或重度(CLcr <30 ml/min)肾损害患者,无需调整剂量。LEVITRA尚未在肾透析患者中进行评估临床药理学代谢和排泄和预防措施).
伴随药物:在接受某些CYP3A4抑制剂(如酮康唑、伊曲康唑、利托那韦、茚地那韦和红霉素)的患者中,LEVITRA的剂量可能需要调整(见警告,预防措施,药物的相互作用).对于利托那韦,72小时内不应超过单剂量2.5 mg LEVITRA。对于茚地那韦、酮康唑400 mg / d、伊曲康唑400 mg / d, 24小时内不应超过2.5 mg LEVITRA单次剂量。酮康唑200mg / d、伊曲康唑200mg / d、红霉素,24小时内不应超过LEVITRA单次5mg剂量。对于α受体阻滞剂,当PDE5抑制剂(包括LEVITRA)与α受体阻滞剂同时使用时,建议谨慎,因为有可能对血压产生附加作用。在一些患者中,同时使用这两类药物可以显著降低血压预防措施,阿尔法受体阻滞剂和药物的相互作用)导致症状性低血压(例如昏厥)。只有当患者的α受体阻滞剂治疗稳定时,才应开始伴随治疗。对于α -受体阻滞剂治疗稳定的患者,LEVITRA起始剂量应为5mg(与某些CYP3A4抑制剂同时使用时为2.5 mg)药物的相互作用).
如何提供
LEVITRA (HCl伐地那非)为橙色薄膜包衣圆形片剂,一面有“BAYER”十字,另一面有“2.5”、“5”、“10”和“20”,分别相当于2.5 mg、5 mg、10 mg和20 mg伐地那非。
| 包 | 强度 | NDC代码 |
| 30瓶装 | 2.5毫克 | 0026-8710-69 |
| 5毫克 | 0026-8720-69 | |
| 10毫克 | 0026-8730-69 | |
| 20毫克 | 0026-8740-69 |
建议储存:储存在25°C(77°F);允许15-30°C(59-86°F)的远足[见USP控制的室温]。
拜耳制药公司,CT, Morgan Lane West Haven, 400号,06516,德国制造

LEVITRA是Bayer Aktiengesellschaft的注册商标,由GlaxoSmithKline和Schering Corporation授权使用。
继续
APA的参考
Staff, H.(2008年12月28日)。艾力达完整处方信息,HealthyPlace。检索时间:2022年6月19日,网址://www.lharmeroult.com/sex/treatment/levitra-full-prescription-information